Pesquisadores da Universidade de São Paulo (USP) sintetizaram um peptídeo inspirado no receptor natural do vírus SARS-CoV-2 nas células humanas, a proteína ACE2. A molécula se mostrou capaz de proteger células pulmonares humanas da infecção nos testes in vitro. Além disso, tratou a inflamação causada pelo vírus em camundongos suscetíveis à COVID-19.
Siga nosso canal no WhatsApp e receba em primeira mão notícias relevantes para o seu dia
Esses resultados foram publicados na revista Antiviral Research, indicando um possível caminho para a criação de medicamentos do tipo bloqueadores antivirais mais eficazes contra a doença, que já matou mais de 700 mil brasileiros.
Como lembram os autores no artigo, o vírus SARS-CoV-2 conecta sua proteína spike (S) à proteína ACE2 localizada na superfície das células humanas para invadi-las.
“O momento da infecção acontece como se fosse o encaixe entre uma chave e uma fechadura”, compara Geraldo Aleixo Passos, professor do Departamento de Biologia Básica e Oral da Faculdade de Odontologia de Ribeirão Preto (Forp-USP) e um dos coordenadores da pesquisa. “A ‘chave’ representa a proteína spike do vírus, e a fechadura, o receptor ACE2 das células humanas. Os ‘dentes’ da chave, ou seja, os resíduos de aminoácidos da spike, são complementares ao ‘segredo fechadura’, os aminoácidos ACE2.” Os resíduos de aminoácidos da spike e da ACE2 interagem entre si e isso “abre a porta” para o vírus infectar as células humanas.
Quanto melhor for essa interação, maior será o potencial de infecção do vírus – este é, inclusive, o fator que tornou a variante B.1.1.7 do SARS-CoV-2 tão mais contagiosa, como mostrou artigo do mesmo grupo de pesquisadores divulgado em 2021 na plataforma bioRxiv. (leia mais em: agencia.fapesp.br/34932).
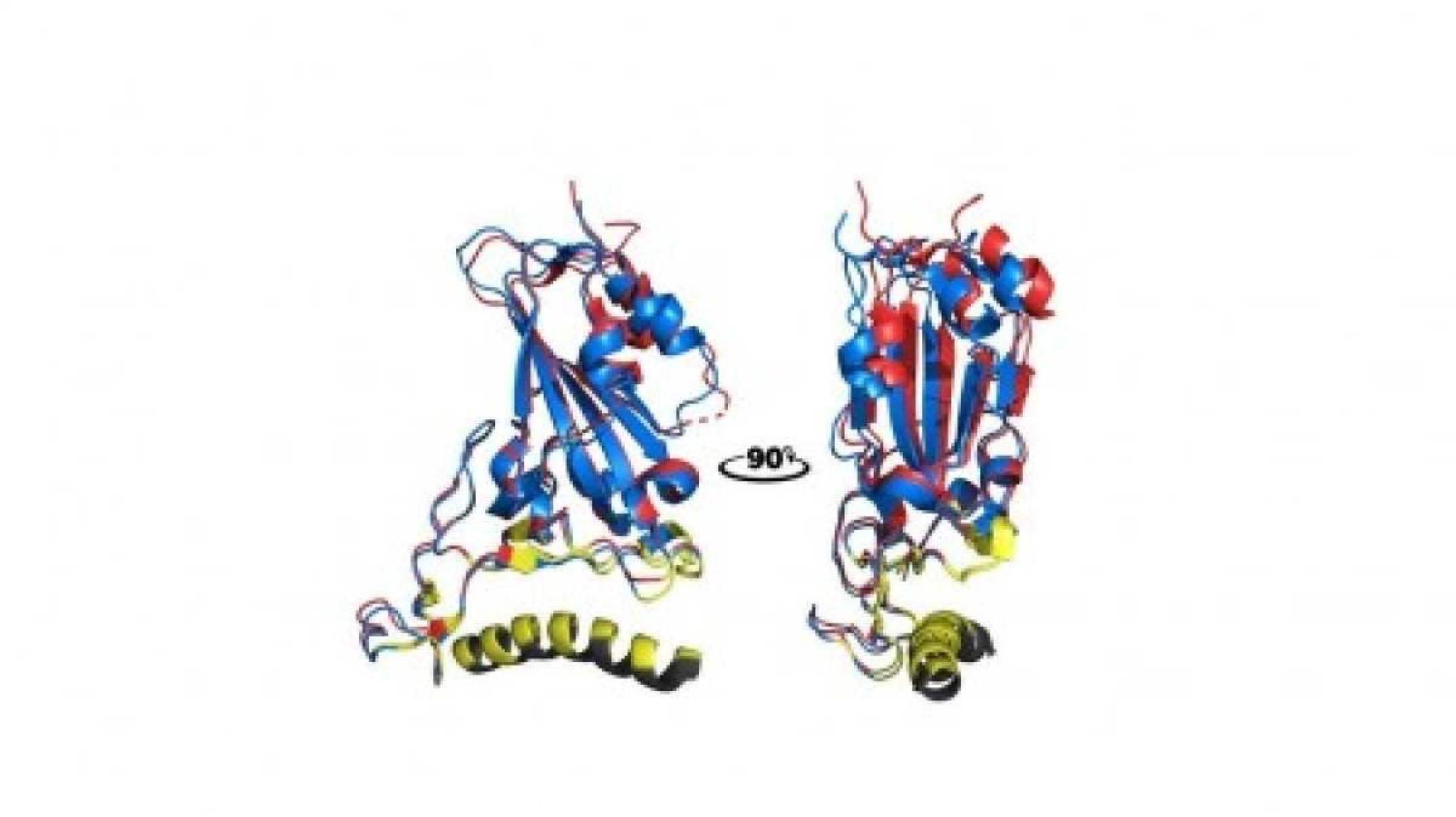
Neste novo estudo financiado pela FAPESP (projetos 17/10780-4 e -19/02418-9), os cientistas investigaram maneiras de bloquear a ligação da spike com a ACE2 e, consequentemente, proteger as células humanas da infecção. Para isso, desenharam um peptídeo mimético (semelhante) ao receptor ACE2 por meio de programas de bioinformática de proteínas e testaram modificações em seus resíduos de aminoácidos – na analogia feita por Passos, os cientistas mexeram no “segredo da fechadura”.
Durante esse processo, descobriram que algumas partes específicas do receptor ACE2 – mais especificamente os resíduos de aminoácidos F28, K31, F32, F40 e Y41 presentes na alfa hélice 1, uma das estruturas secundárias dessa proteína – são cruciais nessa interação.
Experimentos in vitro utilizando células pulmonares humanas em cultura e in vivo com camundongos suscetíveis ao vírus confirmaram que o peptídeo sintético foi capaz não só de controlar a infecção, mas também de tratar os animais que haviam sido previamente infectados, fazendo com que a inflamação pulmonar causada pela COVID-19 diminuísse drasticamente.
“Nós conseguimos ‘enganar’ o vírus, dando a ele uma parte do receptor ACE2 livre [o peptídeo sintético], que, interagindo com a spike antes que essa proteína se ligasse à superfície das células, obstruiu sua entrada. Estudando as bases estruturais do reconhecimento do receptor ACE2 pelo SARS-CoV-2, nós elaboramos uma barreira molecular contra o vírus”, explica Passos.
Tratamento para imunossuprimidos
“A COVID-19 foi controlada com a vacinação em massa, que reduziu drasticamente o número de casos e mortes, sendo, portanto, a melhor opção para evitar que a doença se espalhe nas populações. Mas o vírus SARS-CoV-2 ainda está em circulação, infectando milhares de pessoas no mundo. Além, disso, o vírus circulante pode sofrer novas mutações. Estudos sobre sua evolução indicam que a perspectiva de novas epidemias ou até mesmo uma pandemia como a causada pela cepa original de Wuhan e linhagens subsequentes é plausível e, justamente por isso, nós, cientistas, precisamos continuar investigando o assunto”, considera Passos.
De acordo com o pesquisador, um produto como o peptídeo identificado nesse estudo, que não depende do sistema imunológico para atuar, poderá ser desenhado de forma específica para cada nova variante. Como ele tem ação rápida, pois funciona como um escudo molecular, pode ser eficaz para barrar o vírus num curto prazo, especialmente em pacientes imunossuprimidos ou crianças com imunodeficiências e baixa resposta imunológica às vacinas.
O estudo foi multidisciplinar e multicêntrico, reunindo pesquisadores do Centro de Pesquisa em Virologia, do Centro de Pesquisa em Doenças Inflamatórias (CRID) e do Departamento de Genética da Faculdade de Medicina de Ribeirão Preto (FMRP-USP), além do Centro de Tecnologia da Informação Renato Archer (CTI), ligado ao Ministério da Ciência, Tecnologia e Inovação (MCTI). Contou com financiamento do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes).